Isomeria Espacial
Os compostos que sofrem isomeria são denominados de isômeros.
Na isomeria plana, os isômeros diferem um dos outros, apenas pela fórmula estrutural plana. Este tipo de isomeria pode ser dividida em cinco, veja:
1-) Isomeria de posição
Os isômeros pertencem à mesma função química e possuem a mesma cadeia carbônica, diferenciando apenas, pela posição de uma ramificação, ou de um grupo funcional, ou uma insaturação (ligações duplas, ou triplas).
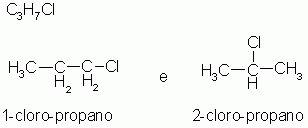 |
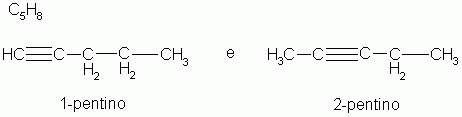 |
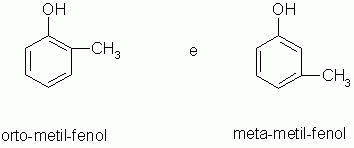 |
2-) Isomeria de cadeia ou núcleo
Os isômeros pertencem à mesma função química, mas possuem cadeias carbônicas diferentes.
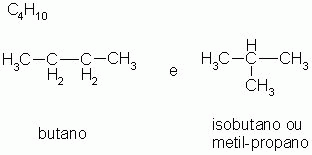 |
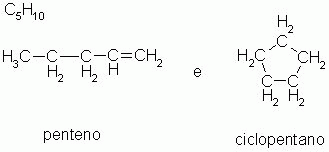 |
O 1-penteno e o ciclopentano são hidrocarbonetos
3-) Isomeria de função
Os isômeros pertencem à funções químicas diferentes.
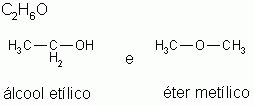 |
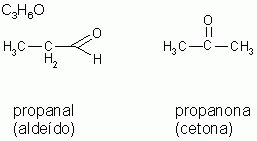 |
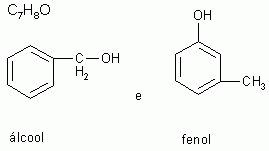 |
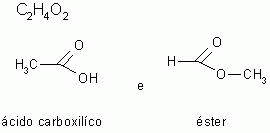 |
4-) Metameria ou isomeria de compensação
Os isômeros pertencem à mesma função e apresentam a mesma cadeia carbônica, mas apresentam diferença na posição do heteroátomo.
A metameria pode ser considerada um caso de isomeria de posição. (Heteroátomo - átomo dentro da cadeia carbônica diferente do carbono. São considerados heteroátomos: N, O, P, S.)
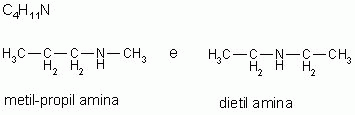 |
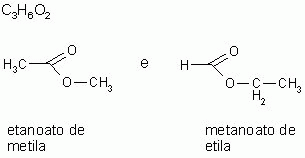 |
5-) Tautomeria
É um caso especial de isomeria de função.
A tautomeria acontece quando ocorre um rearranjo de átomos ou grupo de átomos em uma molécula. Isso ocorre como em uma reação, onde um composto se transforma em outro, sendo mantido um equilíbrio.
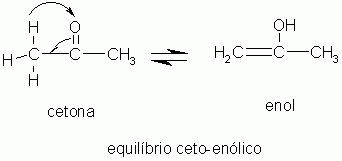 |
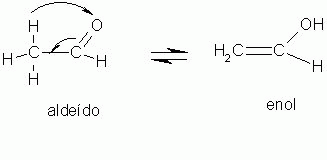 |
Os isômeros espaciais possuem a mesma fórmula molecular e também a mesma fórmula estrutural plana, diferenciando apenas nas fórmulas estruturais espaciais.
Os isômeros espaciais podem ser divididos em geométricos e ópticos.
Isomeria geométrica (cis-trans ou Z-E)
Os isômeros são compostos que possuem a distribuição espacial diferentes. Este tipo de isomeria espacial, ocorre, caso existam ligações duplas ou cadeia fechada ou ainda, os ligantes estejam ligados à carbonos diferentes.
Os isômeros podem ser classificados como cis(Z) ou trans(E).
cis(Z) - do mesmo lado, juntos, no mesmo lado do plano de simetria.
trans(E) - em lados opostos do plano de simetria.
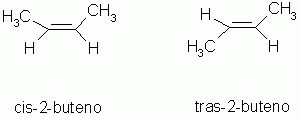 |
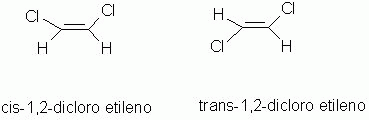 |
Os isômeros cis e trans possuem propriedades físicas diferentes, tais como, PF, PE e densidade.
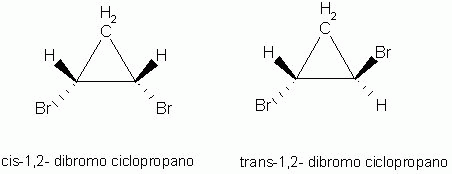
Isomeria Óptica
Todos os isômeros possuem propriedades físicas diferentes, tais como PF, PE e densidade, mas os isômeros ópticos não possuem esta diferença, ou seja, as propriedades físicas dos isômeros ópticos são as mesmas. Então o que faz eles serem diferentes?
É possível diferenciá-los?
Sim, é possível diferenciá-los, mas apenas quando eles estão frente à luz polarizada.
Luz polarizada - é um conjunto de ondas eletromagnéticas que se propagam em apenas uma direção.
Uma lâmpada incandescente é um exemplo de fonte de luz não polarizada, pois a luz é emitida em todas as direções.
É possível polarizar luz não polarizada, bastando utilizar um polarizador, que terá a função de direcionar apenas uma direção da luz.
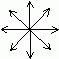 luz não polarizada luz não polarizada |
esta seta de duas pontas, ![]() , significa a propagação da onda eletromagnética (luz polarizada) vista de frente.
, significa a propagação da onda eletromagnética (luz polarizada) vista de frente.
Isômeros ópticos
Enantiômeros:
Os isômeros ópticos são compostos capazes de desviar a luz polarizada. Caso o isômero óptico provoque o giro da luz polarizada para a direita, o enantiômero é denominado dextrógiro (D, +). Caso o enantiômero provoque o giro da luz polarizada para a esquerda, o composto é denominado levógiro (L, -).
É necessário atenção, pois os enantiômeros não são superponíveis, assim como o levógiro não se superpõe ao dextrógiro.
O fato de um composto provocar o "giro" da luz polarizada, faz com que ele possua atividade óptica.
Atividade óptica só é possível em moléculas assimétricas, ou seja, moléculas que possuem carbono quiral (ou estereocentro).
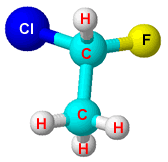 | o carbono quiral é marcado com um asterísco (*),este carbono possui todos os ligantes diferentes. |
 |  | 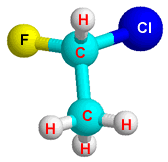 |
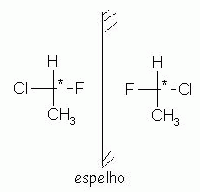 |
Compostos enantioméricos, um é a imagem especular do outro, ou seja, um é a imagem refletida do outro. No entanto, eles não são superponíveis. Um exemplo disso, são as mãos, direita e esquerda. Uma é a imagem da outra, mas não são superponíveis. Tente verificar este fato com suas mãos, coloque uma na frente da outra. (Uma será a imagem da outra).
Agora tente colocar uma sobre a outra. (As mãos não são superponíveis, ou seja, os dedos polegares não ficam um sobre o outro). Considere isso como um exemplo para entender o fato da assimetria molecular.
Mistura racêmica é uma mistura de isômeros ópticos, ou seja, é uma mistura de 50% de levógiro e 50% de dextrógiro.
A quantidade de isômeros opticamente ativos, pode ser dada a partir da quantidade de carbonos quirais em uma molécula.
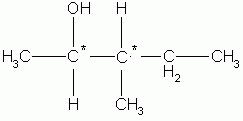
2 estereocentros
IOA- isômero óticamente ativoIOA = 2n , sendo n o número de estereocentros.
Para a molécula dada, temos:
IOA = 22 = 4 , 4 isômeros ópticos ativos
*O texto e as figuras desta página foram produzidos por Miguel A. Medeiros. A reprodução destes, merece autorização ou referência ao autor. Além do endereço desta página.
Escrito por: Miguel A. Medeiros
Publicado em: 03 de agosto de 2002
01. Considerando-se a posição dos grupos ¾ CH3 no anel aromático, o metilbenzeno possui:
a) 10 isômetros.
b) 6 isômetros.
c) 5 isômetros.
d) 3 isômetros.
e) 2 isômetros.
Resposta: D
02. (PUC-SP) Os dois compostos H3C – O – CH3 e H3C – CH2 – OH demonstram que caso de Isomeria?
a) cadeia
b) posição
c) composição
d) função
e) tautomeria
Resposta: D
03. (FMU) O equilíbrio H3C – C – CH3 ⇄ H3C – C = CH2 pode ser chamado:
|| |
O OH
a) reação ácido base
b) tautomeria
c) ressonância
d) reação de óxido-redução
e) hidrólise
Resposta: B
04. (PUC) O ciclo butano e buteno 2 são isômeros:
a) geométricos
b) ópticos
c) posição
d) cadeia
e) compensação
Resposta: D
05. (FMU) São isômeros funcionais:
01. butano e metil propano
02. etanol e éter dimetílico
04. 1 cloro propano e 2 cloro propano
08. 1,2 dimetil benzeno e 1,4 dimetil benzeno
16. propanona e propanal
32. etanal e propanona
ResOLUÇÃO: 18
06. (CATANDUVA) Butanal e metil propanal são isômeros de:
a) função
b) cadeia
c) compensação
d) posição
e) n.d.a.
Resposta: B
07. (OSEC) A substituição de um dos átomos de hidrogênio do anel aromático do fenol por um átomo X possibilita a formação de um número de isômeros de posição igual a:
a) 5
b) 4
c) 3
d) 2
e) 1
Resposta: C
08. (USP) Com a fórmula molecular C4H10 são conhecidos:
a) um composto
b) dois compostos
c) três compostos
d) quatro compostos
e) não sei
Resposta: B
09. (USP) Dado os compostos:
I. H3C – C – O – CH3
H2
II. H3C – C – CH2OH
H2
III. H3C – CH2CHO
IV. H3C – CH – CH3
|
OH
São isômeras somente as substâncias de fórmulas:
a) I e II
b) I e III
c) II e IV
d) I, II e IV
e) II, III e IV
Resposta: D
10. (UnB) Quantos isômeros planos são possíveis para um composto que apresenta fórmula molecular C4H11N?
a) 3
b) 5
c) 7
d) 8
e) n.d.a.
Resposta: D
11. (OSEC) A propanona e o isopropenol exemplificam um caso de Isomeria:
a) de cadeia
b) de metameria
c) de função
d) de tautomeria
e) cis-tran
Resposta:D
MUSICA DA ISOMERIA
COMPOSTOS DE FORMULA MOLECULAR,
E DIFERENÇA APENAS NA ESTRUTURAL,
É ISOMERIA, MEU BEM É ISOMERIAAA.
PODE SER PLANA OU ATE MESMA A ESPACIAL,
NÃO TEM PROBLEMA COM A OPTICA SE TIVER QUIRAL,
O QUIRAL TEM, MEU BEM LÁ TEM QUE TER.
SE FOR PLANA É ASSIM, CADEIA OU POSIÇÃO,
ALGUNS FALAM QUE A METAMERIA É UMA COMPENSAÇÃO.
E QUANDO MUDA A FUNÇÃO, VOU CHEIO DE ALEGRIA,
COM A PRESENÇA DO ENOL É CLARO QUE É TALTOMERIA.
QUIRAL PEGA A LUZ E VIRA PRO LADO E PRO OUTRO, CHAMADA DE OPTICA.
JÁ A ESPACIAAAL,
PEGA O COMPOSTO E DIVIDE PRA FINALIZAAA,
DO MESMO LADO É CIS, DO OUTRO LADO TRANS FAZ GIRAAR.










