
No foguete quando o combustível é oxidado na câmara de combustão, libera-se calor aumentando a energia cinética de suas moléculas. Assim que os gases quentes são expelidos pelo escapamento, essa energia é utilizada para lançar o projétil.
Teoria da colisão
Pela teoria da colisão, para haver reação é necessário que:
- as moléculas dos reagentes colidam entre si;
- a colisão ocorra com geometria favorável à formação do complexo ativado;
- a energia das moléculas que colidem entre si seja igual ou superior à energia de ativação.
Colisão efetiva ou eficaz é aquela que resulta em reação, isto é, que está de acordo com as duas últimas condições da teoria da colisão. O número de colisões efetivas ou eficazes é muito pequeno comparado ao número total de colisões que ocorrem entre as moléculas dos reagentes.
Quanto menor for a energia de ativação de uma reação, maior será sua velocidade.
Uma elevação da temperatura aumenta a velocidade de uma reação porque aumenta o número de moléculas dos reagentes com energia superior à de ativação.
A + B ![]() C + D
C + D
A velocidade de uma reação é a rapidez com que os reagentes são consumidos ou rapidez com que os produtos são formados. A combustão de uma vela e a formação de ferrugem são exemplos de reações lentas. Na dinamite, a decomposição da nitroglicerina é uma reação rápida.
As velocidades das reações químicas são determinadas através de leis empíricas, chamadas leis da velocidade, deduzidas a partir do efeito da concentração dos reagentes e produtos na velocidade da reação.
As reações químicas ocorrem com velocidades diferentes e estas podem ser alteradas, porque além da concentração de reagentes e produtos, as velocidades das reações dependem também de outros fatores como:
Concentração de reagentes: quanto maior a concentração dos reagentes maior será a velocidade da reação. Para que aconteça uma reação entre duas ou mais substâncias é necessário que as moléculas se choquem, de modo que haja quebra das ligações com conseqüente formação de outras novas. O número de colisões irá depender das concentrações de A e B. Veja a figura:
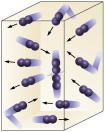
Moléculas se colidem com maior freqüência se
aumentarmos o número de moléculas reagentes.
É fácil perceber que devido a uma maior concentração haverá aumento das colisões entre as moléculas.
Superfície de contato: um aumento da superfície de contato aumenta a velocidade da reação. Um exemplo é quando dissolvemos um comprimido de sonrisal triturado e ele se dissolve mais rapidamente do que se estivesse inteiro, isto acontece porque aumentamos a superfície de contato que reage com a água.
Pressão: quando se aumenta a pressão de um sistema gasoso, aumenta-se a velocidade da reação.

Um aumento na pressão de P1 para P 2 reduziu o volume de V1 para V1/2, acelerando a reação devido à aproximação das moléculas.
A figura acima exemplifica, pois com a diminuição do volume no segundo recipiente, haverá um aumento da pressão intensificando as colisões das moléculas e em conseqüência ocorrerá um aumento na velocidade da reação.
Temperatura: quando se aumenta a temperatura de um sistema, ocorre também um aumento na velocidade da reação. Aumentar a temperatura significa aumentar a energia cinética das moléculas. No nosso dia-a-dia podemos observar esse fator quando estamos cozinhando e aumentamos a chama do fogão para que o alimento atinja o grau de cozimento mais rápido.
Catalisadores: os catalisadores são substâncias que aceleram o mecanismo sem sofrerem alteração permanente, isto é, durante a reação eles não são consumidos. Os catalisadores permitem que a reação tome um caminho alternativo, que exige menor energia de ativação, fazendo com que a reação se processe mais rapidamente. É importante lembrar que um catalisador acelera a reação mais não aumenta o rendimento, ou seja, ele produz a mesma quantidade de produto, mas num período de menor tempo.
A principal função do catalisador é diminuir a energia de ativação, facilitando a transformação de reagentes em produtos. Observe o gráfico que demonstra uma reação com e sem catalisador:

Inibidor: é uma substância que retarda a velocidade da reação.
Veneno: é uma substância que anula o efeito de um catalisador.
A ação do catalisador é abaixar a energia de ativação, possibilitando um novo caminho para a reação. O abaixamento da energia de ativação é que determina o aumento da velocidade da reação.
- Catálise homogênea - Catalisador e reagentes constituem uma só fase.
- Catálise heterogênea - Catalisador e reagentes constituem duas ou mais fases (sistema polifásico ou mistura heterogênea).
Autocatálise
Autocatálise - Quando um dos produtos da reação atua como catalisador. No início, a reação é lenta e, à medida que o catalisador (produto) vai se formando, sua velocidade vai aumentando.
Regra de van't Hoff - Uma elevação de 10°C duplica a velocidade de uma reação.
Esta é uma regra aproximada e muito limitada.
O aumento da concentração dos reagentes aumenta a velocidade da reação.
Conclusão
Na cinética estuda-se a velocidade das reações químicas.
As velocidades das reações químicas são expressas por M/s “molaridade por segundo”.
Quanto maior for a temperatura, maior será a velocidade, existindo fatores que influenciam nessa velocidade, como “superfície”, “temperatura” e “concentração dos reagentes”, onde, quanto maior for a superfície de contato maior será a velocidade de reação, quanto maior a temperatura maior será a velocidade de reação, quanto maior for a concentração dos reagentes maior será a velocidade de reação.
“lei de Guldberg-Waage” lei onde a ordem de uma reação é a soma dos expoentes das concentrações da equação da velocidade
Existe uma energia mínima para que os reagentes se transformem em produto, essa “energia mínima” da se o nome de “energia de ativação”, quanto maior for a energia de ativação, menor será a velocidade da reação.
Para diminuir essa “energia de ativação” pode-se usar um catalisador que facilita a transformação de reagentes em produtos.
A lei de Guldberg-Waage:
Considere a seguinte reação: a A + b B ----------> c C + d D
Segundo a lei de Guldberg-Waage; V = k [A]a [B]b.
Onde:
- V = velocidade da reação;
- [ ] = concentração da substância em mol / L;
- k = constante da velocidade específica para cada temperatura.
A ordem de uma reação é a soma dos expoentes das concentrações da equação da velocidade. Utilizando a equação anterior, calculamos a ordem de tal reação pela soma de (a + b).
VIDEO-AULAS:
http://www.youtube.com/watch?v=JkGknA64Vfo
INTRODUÇÃO
http://www.youtube.com/watch?v=R0W7I5jNdto&feature=related
VELOCIDEDA DE UMA REAÇÃO
http://www.youtube.com/watch?v=1k3O6g35TJc&feature=related
FATORES QUE ALTERAM A VELOCIDADE
EXERCICIOS RESOLVIDOS:
1. Aplique a equação de Gulberg Waage (lei da ação das massas) às reações apresentadas:
a) 2 N2(g) + 3 O2(g) => 2 N2O3(g)
b) 2 NO2(g) => N2O4(g)
Resolução: a) V = k [N2]2 [O2]3
b) V = k [NO2]2
2. Por que o catalisador altera velocidade de uma reação?
Resolução:Porque diminui a energia de ativação dos reagentes.
3. É incorreto dizer-se que um catalisador,
01. altera a energia de ativação de uma reação
02. altera a velocidade de uma reação
04. altera o pH da reação
RESOLUÇÃO: 4
4. Assinale as opções corretas:
01. O catalisador afeta a velocidade de uma reação porque aumenta o número de moléculas com energia
cinética maior ou igual à energia de ativação da reação.
02. A temperatura afeta a velocidade de uma reação porque muda a energia de ativação da reação.
04. A concentração dos reagentes afeta a velocidade de uma reação porque há alteração no número de colisões efetivas.
08. Uma reação ocorre quando há colisão efetiva entre as moléculas reagentes, numa orientação apropriada.
5. Justifique sua RESPOSTA ao item 08 da questão anterior.
RESOLUÇÃO: CERTA, a reação ocorre quando moléculas ativadas energicamente chocam-se numa orientação apropriada, isto é, que possibilite a quebra de ligações nos reagentes.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Nenhum comentário:
Postar um comentário